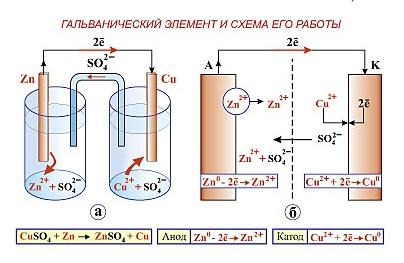
Гальванические элементы — это устройства, которые способны переводить химическую энергию в электрическую. Они основаны на принципе гальванической реакции, которая происходит между двумя растворами с разными электрохимическими свойствами. Как только происходит реакция, появляются заряды разного знака, создавая ток.
Принцип работы гальванических элементов основан на разности потенциалов между различными электродами, к которым подключены проводники. Этот процесс возможен благодаря взаимодействию активных веществ, из которых состоят электроды, и электролитов, находящихся внутри элемента. Реакция между активными веществами и электролитами приводит к перемещению зарядов и созданию электрического потенциала, который можно использовать для питания различных электрических устройств.
Виды гальванических элементов могут быть различными в зависимости от применяемых электродов и электролитов. Наиболее распространенными типами являются простые элементы, состоящие из одного электрода и одного электролита, и составные элементы, которые состоят из нескольких электродов и электролитов. В простых элементах активным веществом на одном из электродов может быть цинк или другой металл с положительным потенциалом, а на другом электроде — металл с отрицательным потенциалом, например медь или свинцовый диоксид. Составные элементы могут быть более эффективными и обеспечивать более стабильное напряжение.
Характеристики гальванических элементов зависят от типа используемых электродов и электролитов, а также от условий эксплуатации. Наиболее важные характеристики включают емкость элемента, которая определяет его способность поставлять электрическую энергию, и напряжение, которое создается между электродами элемента. Также важными характеристиками являются длительность работы, степень разряда и возможность замены или перезарядки элемента. На основе этих характеристик можно выбрать наиболее подходящий гальванический элемент для конкретного применения.
Гальванические элементы — устройство, принцип работы, виды и характеристики [Электроприборы pribory]
Основные компоненты гальванического элемента:
- Анод — электрод, на котором происходит окисление вещества
- Катод — электрод, на котором происходит восстановление вещества
- Электролит — раствор, который содержит ионы и обеспечивает проводимость электрического тока между электродами
Существует несколько видов гальванических элементов, в зависимости от используемых веществ и принципа работы:
- Одноступенчатые элементы — используют одну реакцию окисления и одну реакцию восстановления, например, алкалиновые элементы с цинк-гидроксидной химией
- Двухступенчатые элементы — включают две различные реакции окисления и восстановления, например, свинцово-кислородные элементы
- Топливные элементы — используют в качестве реактивов топливо и окислитель, например, горючий элемент
Характеристики гальванического элемента определяют его электрические параметры:
| Напряжение | Емкость | Срок службы |
|---|---|---|
| Определяет разность потенциалов между анодом и катодом | Определяет количество электрического заряда, которое может быть поставлено или получено от элемента | Определяется химической реакцией в элементе и может быть различным для разных типов элементов |
Гальванические элементы широко применяются в электронике, автомобильной промышленности, бытовых приборах и других областях, где требуется надежный источник электрической энергии.
Устройство гальванических элементов
Главные компоненты гальванического элемента:
- Анод: это положительный электрод, на котором происходит окислительная реакция. Анод отдает электроны во внешнюю среду.
- Катод: это отрицательный электрод, на котором происходит восстановительная реакция. Катод принимает электроны из внешней среды.
- Электролит: это вещество, которое содержит ионы и обеспечивает их перемещение между анодом и катодом. Электролит может быть жидким или твердым.
Принцип работы гальванического элемента основан на разности потенциалов между анодом и катодом. Анод имеет более высокий потенциал, чем катод, что вызывает движение электронов от анода к катоду через внешнюю среду. Это движение электронов создает электрический ток, который может использоваться для работы устройств.
Различные виды гальванических элементов могут быть созданы путем использования разных материалов для анода и катода, а также разных электролитов. Например, в самых простых гальванических элементах, таких как цинковые и медные элементы, цинк служит анодом, медь — катодом и серная кислота или соляная кислота — электролитом.
Гальванические элементы широко используются в различных областях, включая электронику, энергетику, автомобильную промышленность и другие. Они позволяют преобразовывать химическую энергию в электрическую и обеспечивать независимое питание для различных устройств.
Электролит и электроды
Гальванический элемент состоит из двух электродов, которые погружены в электролит. Электролит представляет собой вещество, способное проводить электрический ток в виде ионов. Он обладает двумя проводящими свойствами: электролит может ионизироваться и проводить электроны через свою поверхность.
Один из электродов является анодом, а другой – катодом. Анод – это положительно заряженный электрод, на котором происходит окисление (потеря электронов). Катод – отрицательно заряженный электрод, на котором происходит восстановление (приобретение электронов).
В качестве электродов могут использоваться разные материалы, в зависимости от эксплуатационных условий и требований. Например, в гальванических элементах, используемых в автомобильных аккумуляторах, в качестве анода обычно применяется свинцовая цинковая корзина, а в качестве катода – графитовая пластина. Для повышения электрохимической активности катод обычно покрывается автомобильной пастой. В других типах гальванических элементов могут использоваться другие материалы, например, медь, никелевая пластина или серебро.
| Электрод | Анод | Катод |
|---|---|---|
| Пример материала | Свинец | Графит |
| Функция | Окисление | Восстановление |
Таким образом, электролит и электроды играют важную роль в гальванических элементах, обеспечивая проводимость тока и электрохимические реакции, которые приводят к выработке электрической энергии.
Реакция окисления и восстановления
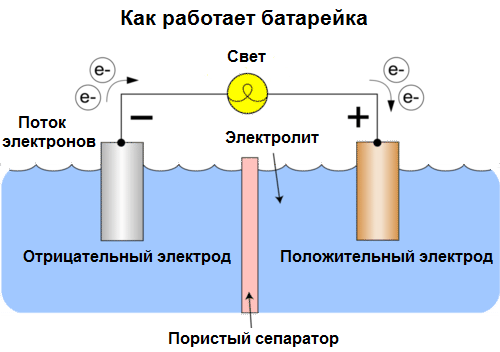
Реакция окисления на аноде сопровождается образованием ионов, которые переходят в электролит, а реакция восстановления на катоде сопровождается выделением ионов из электролита на поверхность катода. Это позволяет поддерживать электрическую нейтральность системы.
Реакция окисления и восстановления позволяет гальваническому элементу генерировать постоянный электрический ток. Этот процесс может продолжаться до тех пор, пока реагенты, участвующие в реакции окисления и восстановления, не будут исчерпаны.
Принцип работы гальванических элементов
Основным принципом работы гальванических элементов является разность потенциалов между двумя электродами. Один из электродов имеет отрицательный заряд и называется анодом, а другой электрод имеет положительный заряд и называется катодом.
Когда гальванический элемент подключается к внешней цепи, начинается электрохимическая реакция. На аноде происходит окисление металла, при котором электроны выделяются и поступают во внешнюю цепь, двигаясь к катоду. На катоде происходит восстановление металла, при котором электроны поглощаются и переходят в электролит.
Электролит между анодом и катодом служит для передачи ионов, которые несут электрический заряд. Они перемещаются через электролит, обеспечивая непрерывность электрохимической реакции.
Разность потенциалов между анодом и катодом создает электрическое поле, которое приводит к движению электронов во внешней цепи. Это движение электронов создает электрический ток, который может использоваться для питания электрических устройств.
Таким образом, принцип работы гальванических элементов основан на электрохимических реакциях, разности потенциалов и перемещении ионов через электролит.
Потенциал электродов
У каждого электрода есть свой потенциал, который зависит от физико-химических свойств материала электрода и условий окружающей среды. Потенциалы электродов измеряются относительно стандартного электрода, который выбирается за исходную точку с нулевым потенциалом.
По значению потенциала электроды можно разделить на три основных типа: анионы, катионы и составные электроды.
Анион – это электрод, на котором происходит окислительный процесс, то есть отдача электронов. Анион имеет положительный потенциал.
Катион – это электрод, на котором происходит восстановительный процесс, то есть принятие электронов. Катион имеет отрицательный потенциал.
Составной электрод – это электрод, состоящий из нескольких материалов. Потенциал составного электрода вычисляется суммированием потенциалов каждого из его компонентов.
Знание потенциалов электродов позволяет определить направление и скорость электрохимических реакций, а также использовать электроды в различных гальванических элементах для получения электрической энергии.
Поток электронов и ток гальванического элемента
Источником электронов в гальваническом элементе является один из электродов – металлический проводник, который погружен в электролит. Электролит представляет собой раствор ионов, которые способны перемещаться в электрическом поле.
Ионный перенос в электролите вызывает разность потенциалов между электродами, что приводит к движению электронов. Электроны начинают двигаться от одного электрода к другому, создавая электрический ток.
Сила тока, генерируемого гальваническим элементом, зависит от ряда факторов, включая концентрацию ионов в электролите, разность потенциалов между электродами и внешнее сопротивление цепи. Чем больше разность потенциалов и ниже сопротивление цепи, тем больше будет ток, проходящий через гальванический элемент.
Ток, который проходит через гальванический элемент, измеряется в амперах (А). Этот параметр является одним из основных характеристик гальванических элементов и позволяет определить их эффективность и работу в различных условиях.
| Параметр | Значение |
|---|---|
| Ток | Измеряется в амперах (А) |
| Сопротивление цепи | Определяет эффективность передачи электрического тока |
| Разность потенциалов | Создает электрическое поле, способствующее движению электронов |
| Концентрация ионов | Определяет скорость ионного переноса и эффективность гальванического элемента |
Виды гальванических элементов
Гальванические элементы, или просто элементы, представляют собой устройства, способные преобразовывать химическую энергию в электрическую. Существует несколько типов гальванических элементов, каждый из которых имеет свои особенности и применение.
- Элементы с жидкими электролитами — такие элементы используются в батарейках типа «щелочные», «цинковые» и др. Они содержат жидкие электролиты, которые обеспечивают перемещение зарядов внутри элемента.
- Элементы с твердыми электролитами — в таких элементах используются твердые электролиты, которые имеют высокую электропроводность и способны передавать заряды между электродами.
- Элементы с полимерными электролитами — эти элементы отличаются от предыдущих тем, что вместо традиционных электролитов, таких как щелочные или кислотные растворы, они используют полимерные материалы в качестве электролита.
- Топливные элементы — это особый тип элементов, который преобразует энергию химической реакции прямо в электрическую энергию, используя топливо (например, водород) и окислитель (например, кислород).
Каждый вид гальванического элемента имеет свои преимущества и недостатки, и выбор элемента зависит от конкретной задачи, требований по энергоснабжению и других факторов.
Одноразовые элементы
Одноразовые элементы имеют простую конструкцию, состоящую из положительного и отрицательного электрода, разделенных электролитом. Они обычно содержат цинковый электрод в качестве отрицательного полюса и изготовленный из графита или марганцевой диоксидной пасты положительный полюс. Как правило, в качестве электролита используется щелочь или кислота.
Одноразовые элементы обладают низкой стоимостью, легкостью использования и широким спектром применения. Они широко используются в устройствах с низким энергопотреблением, таких как игрушки, наушники, часы, пульты дистанционного управления и других портативных устройствах. Однако, они имеют относительно низкую энергетическую плотность и недолгий срок службы, что делает их неэффективными для использования в устройствах с высоким энергопотреблением.
Наиболее распространенными типами одноразовых элементов являются щелочные и цинковые углекислотные. Щелочные элементы выделяются длительным сроком службы, высокой энергетической плотностью и способностью работать при высоких нагрузках. Цинковые углекислотные элементы, такие как батарейки AA или AAA, характеризуются низкой стоимостью и широким распространением.
Одноразовые элементы являются незаменимым и удобным источником энергии для многих устройств. Они позволяют обеспечить портативные устройства надежным и долгосрочным питанием без необходимости в постоянной зарядке. Однако, для устройств с высоким энергопотреблением или требующих постоянного обновления батареек, более эффективным решением являются аккумуляторы или другие типы гальванических элементов, которые можно перезарядить или заменить.
Перезаряжаемые элементы

Основными преимуществами перезаряжаемых элементов являются их долгий срок службы, экономичность и малое воздействие на окружающую среду. Аккумуляторы могут быть использованы в широком спектре устройств, начиная от мобильных телефонов и ноутбуков до электромобилей и солнечных батарей.
Перезаряжаемые элементы работают по принципу обратимой химической реакции, которая происходит между двумя электродами в электролите. При разряде аккумулятора, электролит взаимодействует с электродами, что вызывает поток электрического тока через внешнюю цепь. При этом происходит преобразование химической энергии в электрическую.
| Вид аккумулятора | Преимущества | Недостатки |
|---|---|---|
| Свинцово-кислотный аккумулятор | Дешевизна, высокая плотность энергии, широкий диапазон рабочих температур | Тяжесть, малый срок службы, высокая саморазрядка |
| Литий-ионный аккумулятор | Высокая плотность энергии, небольшой вес, низкий уровень саморазряда | Высокая стоимость, ограниченный ресурс циклов заряд-разряд |
| Никель-металл-гидридный аккумулятор | Высокая плотность энергии, отсутствие эффекта памяти, более экологически чистые | Более высокий саморазряд по сравнению с литий-ионными аккумуляторами |
Выбор перезаряжаемого элемента зависит от требований к мощности, весу, стоимости, рабочей температуре и сроку службы. Поэтому перед выбором аккумулятора необходимо учитывать все эти факторы и выбрать подходящий тип для конкретной задачи.
Характеристики гальванических элементов
1. Электродный потенциал:
Гальванические элементы имеют различные электродные потенциалы, которые определяются химическим составом электролита и материалами электродов. Электродный потенциал является основной характеристикой гальванических элементов, так как он определяет направление и силу потока электронов.
2. Напряжение:
Напряжение гальванического элемента определяется разностью электродных потенциалов его электродов. Напряжение может быть различным в зависимости от используемых материалов и концентрации электролита. Напряжение гальванического элемента может быть использовано для питания электрических устройств.
3. Емкость:
Емкость гальванического элемента определяет его способность поставлять электрическую энергию в течение времени. Чем больше емкость, тем больше энергии может поставлять гальванический элемент. Емкость зависит от размера электродов, наличия добавок в электролите и других факторов. Емкость измеряется в ампер-часах (Ач).
4. Срок службы:
Срок службы гальванического элемента определяет время, в течение которого он может поставлять электрическую энергию при определенных условиях использования. Срок службы зависит от множества факторов, включая качество материалов, конструкцию элемента и режим использования. Использование гальванического элемента вне указанных условий может сократить его срок службы.
5. Рабочая температура:
Рабочая температура гальванического элемента определяет диапазон температур, при которых он может обеспечивать надежное питание. Каждый тип гальванического элемента имеет свой диапазон рабочих температур, который может быть ограничен особенностями используемых материалов
Емкость и напряжение
Емкость гальванического элемента характеризует его способность запасать и отдавать электрический заряд. Она измеряется в ампер-часах (А·ч) и показывает, сколько заряда может быть запасено или отдано при полной разрядке или зарядке элемента. Чем больше емкость элемента, тем больше энергии он способен запасать, и тем дольше может прослужить в системе.
Напряжение гальванического элемента указывает на разницу потенциалов между его двумя электродами. Оно измеряется в вольтах (В) и показывает, сколько работы может выполнить элемент при перемещении электрического заряда. Чем выше напряжение элемента, тем больше энергии он способен отдать или взять из внешней системы.
Емкость и напряжение гальванического элемента взаимосвязаны. Обычно элементы с большой емкостью имеют меньшее напряжение, а элементы с высоким напряжением имеют меньшую емкость. Это связано со способом работы элемента и химическими реакциями, происходящими внутри него.
Выбор гальванического элемента для конкретной задачи зависит от требуемых значений емкости и напряжения. Например, для низкотоковых устройств, таких как часы или пульты дистанционного управления, требуется элемент с небольшой емкостью и низким напряжением. А для энергоемких устройств, таких как электромобили или солнечные батареи, нужен элемент с большой емкостью и высоким напряжением.





